近日,昆明医科大学康复学院周兴教授团队联合浙江大学医学院附属第二医院副院长张茂在拟线粒体靶向药物递送治疗创伤性脑损伤(TBI)上取得了一项具有里程碑意义的研究成果。在期刊《Journal of Controlled Release》(中国科学院1区TOP,IF=11.5)发表题为《RVG29 and platelet membrane-modified pseudo-mitochondria for cascade targeting of cyclosporin a in traumatic brain injury》的研究论文,周兴教授为论文末位通讯作者。

TBI是全球范围内导致死亡和残疾的主要原因之一,每年约有5000万新增病例,造成160万人死亡。周兴教授团队针对这一严峻的公共健康问题,展开了深入研究。
环孢素A(CsA)被证实对TBI具有潜在的神经保护作用,但仍存在血脑屏障穿透性差、分布无选择性以及免疫抑制副作用等临床应用的局限性。尤其是TBI患者本身免疫功能受损,极易感染,环孢素A的免疫抑制副作用更是雪上加霜。为解决这些问题,周兴教授团队另辟蹊径。他们借鉴线粒体自身的融合特性,基于线粒体膜构建了拟线粒体,通过与细胞内线粒体融合,成功将所载物质递送至线粒体。在此基础上,团队进一步通过狂犬病病毒糖蛋白29肽(RVG29)和血小板膜修饰拟线粒体,实现了环孢素A向TBI中受损神经元线粒体的级联靶向递送。这种级联靶向递送系统,显著减轻了神经元损伤、神经炎症和免疫抑制,相比单独使用环孢素A效果更显著,并能避免环孢素A带来的免疫抑制副作用。
在研究过程中,团队进行了一系列严格的实验验证。他们通过提取线粒体膜,经超声重组形成拟线粒体纳米囊泡,并对其进行了详细的表征,包括形态、粒径、zeta电位以及关键蛋白的存在等。同时,通过细胞和动物模型实验,验证了该递送系统的有效性和安全性。实验结果表明,这种基于天然生物膜的线粒体靶向递送策略,相比传统的基于三苯基膦(TPP)的靶向策略,具有更强的线粒体靶向能力和更好的安全性,不会对神经元细胞活力和线粒体膜电位造成显著影响。
周兴教授团队与张茂教授团队的这项合作研究,不仅为TBI的治疗提供了一种新的有效方法,也为其他与线粒体功能障碍相关的疾病的治疗开辟了新的思路,有望实现临床转化并极大地改善TBI患者的预后和生活质量。
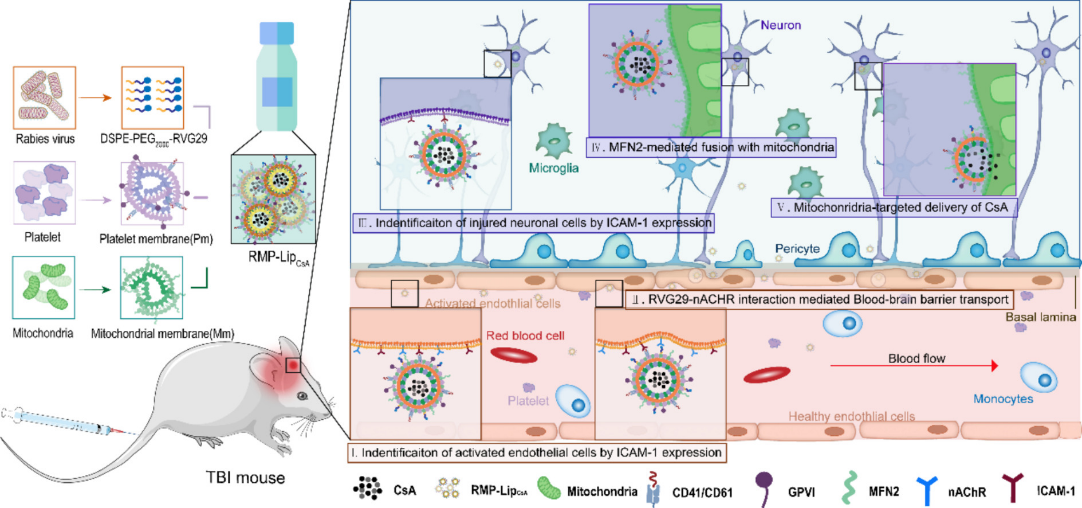
Hu C, Lin Y, Zhang C, Yang J, Lin M, Cui Y, Su Y, Jiang X, Zhang W, Xu J, Zhang M, Zhou X. RVG29 and platelet membrane-modified pseudo-mitochondria for cascade targeting of cyclosporin a in traumatic brain injury.JControl Release.2025 Jul 18;385:114051.doi: 10.1016/j.jconrel.2025.114051.Epub ahead of print.PMID:40684991.
全文链接:
https://authors.elsevier.com/a/1lUYy_3r0J7N-1



