癌蛋白c-Myc作为重要的转录因子,在驱动细胞增殖、代谢重编程、核糖体生物合成等关键致癌进程中扮演着不可替代的角色。c-Myc异常高表达是绝大多数人类恶性肿瘤的普遍标志,直接关联肿瘤的侵袭、转移、复发和耐药。然而,c-Myc蛋白本身因其固有的无序结构特征、缺乏经典小分子结合口袋以及与广泛生理功能的高度关联性,被普遍认为缺乏成药性,难以通过传统抑制剂策略直接靶向。正是这种在促癌机制中的核心地位与直接靶向治疗面临的巨大挑战之间的尖锐矛盾,使得深入解析驱动c-Myc异常表达的分子机制变得尤为迫切。揭示这些调控网络中的关键节点,对于开发间接干预c-Myc致癌活性的新型治疗策略具有重大科学意义和应用前景。
昆明医科大学/中国科学院昆明动物研究所陈策实课题组一直致力于乳腺癌发生发展机制和靶向治疗研究,近年来在恶性乳腺癌转移、化疗和放疗耐受、以及靶向小分子药物研发中取得了一系列研究进展(STTT 2022;eLife 2023;ADV SCI 2023, 2025;Oncogene 2024;JECCR 2024)。鉴于c-Myc的强大促癌活性,且其在高度恶性的三阴性乳腺癌中异常高表达,陈策实课题组多年来一直关注c-Myc的表达调控机制研究。通过与中山大学第一附属医院张弩教授团队合作,发现在三阴性乳腺癌中高表达的长链非编码RNA CDKN2B-AS1能够以CUG为起始密码子(常见的是AUG)编码含66个氨基酸的新小肽66CTG。在细胞周期G1期末或血清饥饿所致的G1期阻滞阶段,66CTG与c-Myc竞争泛素连接酶F-box蛋白FBW7α,减少c-Myc的泛素化降解,通过“牺牲”自己而稳定癌细胞中c-Myc的蛋白水平,进而通过增强Cyclin D1的转录表达而帮助癌细胞通过G1期R检查点,加速细胞周期进程,促进癌细胞增殖和肿瘤生长。66CTG小肽的发现及其参与c-Myc表达调控机制的解析,不仅为c-Myc在三阴性乳腺癌中异常高表达现象提供新的机制,也为间接干预c-Myc的药物研发提供新的研究方向。
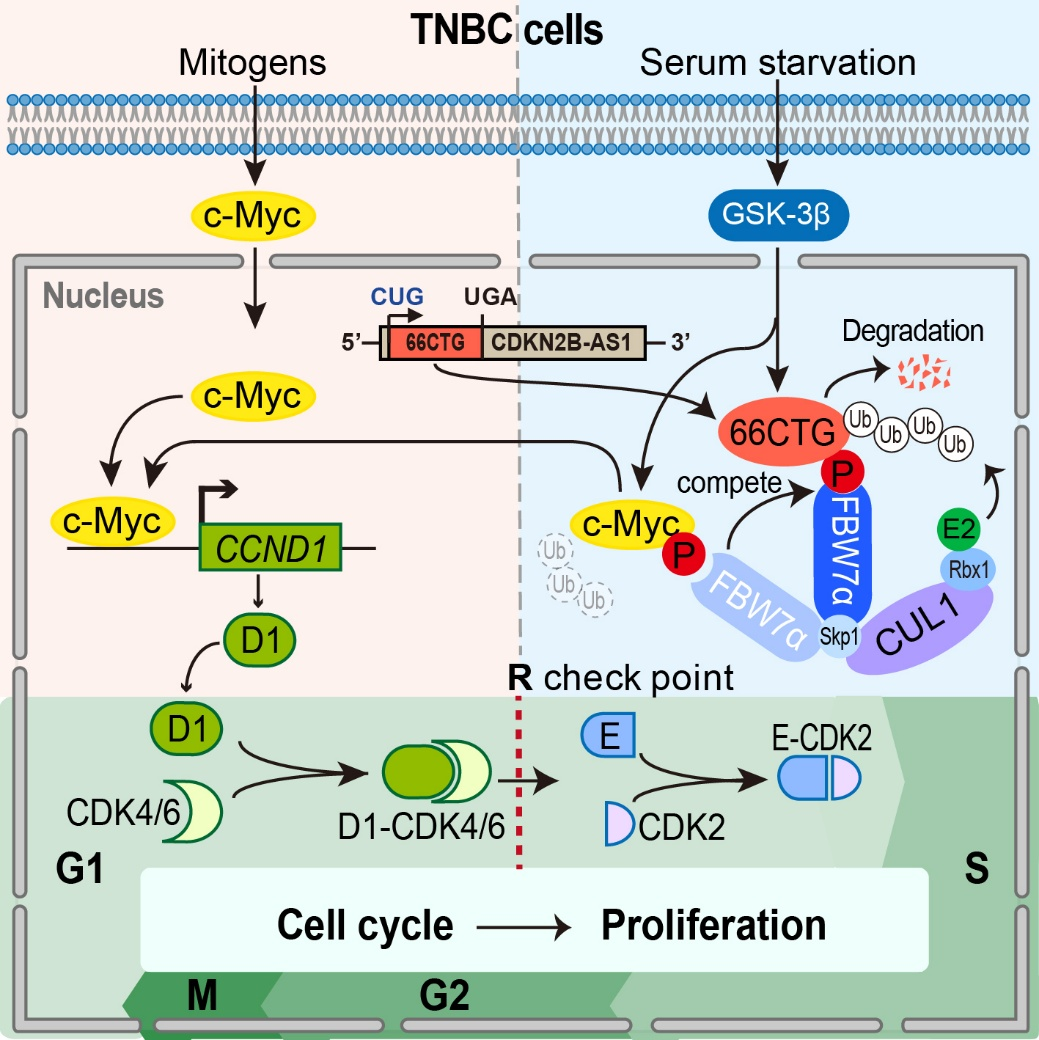
图1. 66CTG小肽稳定c-Myc而加速癌细胞周期进程的机制图。在有丝分裂原刺激下,c-Myc增强Cyclin D1转录表达而促进细胞通过G1期R检查点。当细胞经血清饥饿发生G1期阻滞时,c-Myc因被GSK-3β磷酸化而被FBW7α识别,随后经泛素化-蛋白酶体途径降解。在三阴性乳腺癌中,因66CTG高表达,在G1期末或G1期阻滞阶段,能与c-Myc竞争FBW7α,通过自身降解而稳定c-Myc蛋白,进而帮助癌细胞通过R检查点,加速细胞周期进程,促进癌细胞增殖。
该研究成果于2025年7月9日以标题为A novel peptide 66CTG stabilizes Myc proto-oncogene protein to promote triple-negative breast cancer growth的研究性论文在线发表于Signal Transduction and Targeted Therapy杂志上。昆明医科大学/中国科学院昆明动物研究所陈策实教授、中山大学第一附属医院张弩教授和中国科学院昆明动物研究所蒋德伟研究员是本文的共同通讯作者。中国科学院昆明动物研究所梁慧春助理研究员、昆明医科大学李富兵副教授、中国科学院昆明动物研究所已毕业博士研究生方欢和任文龙为本位的共同第一作者。该项研究得到了国家自然科学基金委、国家重点研发计划项目、云南省科技厅等项目的资助。
文章链接:https://www.nature.com/articles/s41392-025-02298-5
供稿:梁慧春;编校:张志毕;审核:陈亚娟、陈策实

